新标题:多伦多大学团队通过AlphaFold破解蛋白质结构之谜
 发布于2023-11-11 阅读(0)
发布于2023-11-11 阅读(0)
扫一扫,手机访问

编辑 | 萝卜皮
AlphaFold 蛋白质结构数据库包含数百万种蛋白质的预测结构。对于大多数含有本质无序区域 (IDR) 的人类蛋白质,这些区域不采用稳定的结构,通常认为这些区域具有较低的 AlphaFold2 置信度分数,反映了低置信度的结构预测。
多伦多大学(University of Toronto)的研究团队指出,AlphaFold2在近15%的人类不规则区域(IDR)分配中提供了可信的结构。通过与已知条件折叠(即在结合或其他特定条件下)的IDR子集的实验核磁共振(NMR)数据进行比较,研究人员发现AlphaFold2通常能够预测条件折叠状态的结构
根据已知条件折叠的IDR数据库,该团队估计AlphaFold2在10%的误报率下能以高达88%的精度识别条件折叠的IDR。同时,研究人员发现人类疾病突变中条件折叠的IDR比一般IDR丰富近五倍,并且预计原核生物中高达80%的IDR会条件折叠,而真核生物IDR的比例不到20%
这些结果显示,绝大多数人类和其他真核生物的蛋白质组中的无序区域(IDR)在没有条件折叠的情况下起作用,但是那些能够折叠的区域对突变更加敏感。这意味着目前的AlphaFold2预测并没有揭示IDR内与功能相关的结构可塑性,并且无法提供条件折叠的IDR的真实整体表示
该研究以「Systematic identification of conditionally folded intrinsically disordered regions by AlphaFold2」为题,于 2023 年 10 月 25 日发布在《PNAS》。

准确预测 IDR 对人类疾病研究很重要
通过准确预测蛋白质结构的长期目标,最近出现了两种基于深度学习的方法,即AlphaFold2和RoseTTAFold,这两种方法能够高精度地预测蛋白质结构。DeepMind随后成功预测了人类蛋白质组中98.5%的蛋白质结构。与欧洲生物信息学研究所合作,通过AlphaFold蛋白质结构数据库(AFDB),我们可以公开获得许多生物体的蛋白质组结构预测
AFDB的惊人效果是直观展示了本质无序区域(IDR)的普遍存在。据预计,IDR占据人类蛋白质组的30%左右;在转录、翻译和信号传导过程中,它们作为相互作用的中心发挥着重要的细胞功能;此外,IDR也富含与神经系统疾病和其他疾病相关的蛋白质。最近的研究还发现,IDR通过多价相互作用导致相分离,从而促进和调节许多体内生物分子缩合物的形成
在 IDRs 中发现了许多与疾病相关的突变,包括与自闭症谱系障碍(ASD)和癌症有关的突变,涉及 IDRs 的异常相分离与肌萎缩性脊髓侧索硬化症、ASD 和癌症等疾病有关,这突出表明需要了解这些突变的结构和生物物理影响。
准确预测 IDR 还有些困难
在结构层面上,IDR 的定义是缺乏稳定的二级和三级结构以及不同构象之间的快速相互转换。由于其快速动力学,IDR 不适合高分辨率结构测定方法,并且经常被去除或在X射线晶体学和冷冻电子显微镜测定的结构中观察不到。相比之下,AlphaFold2 生成的结构模型包含整个蛋白质序列,包括IDR,现在可以对以前「黑暗」且不可观察的蛋白质组的重要部分进行可视化预测。此外,由于低置信度AlphaFold2 结构预测与内在紊乱之间存在很强的相关性,AlphaFold2 可以作为最先进的紊乱预测器
然而,IDR 并不采用 AFDB 中描述的静态结构。相反,IDR 填充了一个强烈依赖于一级结构的相互转换构象的集合,并且这些集合的特性直接影响 IDR 的功能。然而,通过实验确定的 IDR 构象集合的结构信息仅占可用于折叠蛋白质的一小部分,并且此类集合不会存储在蛋白质数据库 (PDB) 中,它存储为训练 AlphaFold2 和 RoseTTAFold 而挖掘的高分辨率结构。PDB 中折叠 IDR 结构的存在歪曲了 IDR 其他功能状态的观点,并且没有为无数不符合「绑定时折叠」范式的其他 IDR 提供信息。
核磁共振波谱非常适合在原子分辨率下对 IDR 进行基于系综的结构表征。事实上,一系列 NMR 实验已被用来探测 IDR 的构象和其中的残余结构,并使用专门的软件程序专注于整合 NMR 和其他生物物理方法,以确定与实验数据最相符的 IDR 的整体表示。然而,用于确定 IDR 整体表示的综合结构生物学方法和 NMR 驱动的残余结构或二级结构倾向的确定均未存储在用于训练和验证深度学习模型的 PDB 中。
AlphaFold2 在训练时仅使用了排除了 NMR 结构的 PDB 子集,因此 NMR 数据成为评估 AlphaFold2 结构预测准确性的独特验证指标,正如最近的研究所证实的
AlphaFold 带来来新发现
「这一直是生物化学家和分子生物学家之间长期存在的争论——IDR 是否具有固定的结构,或者它们是否只是蛋白质的『软』部分。」多伦多大学细胞与系统生物学系教授、计算生物学家 Alan Moses 说,「我们证实,虽然 AlphaFold2 仍然不能很好地预测 IDR 的结构……它能做的是告诉我们哪些 IDR 可能具有某种结构——这在以前是不可能的。」
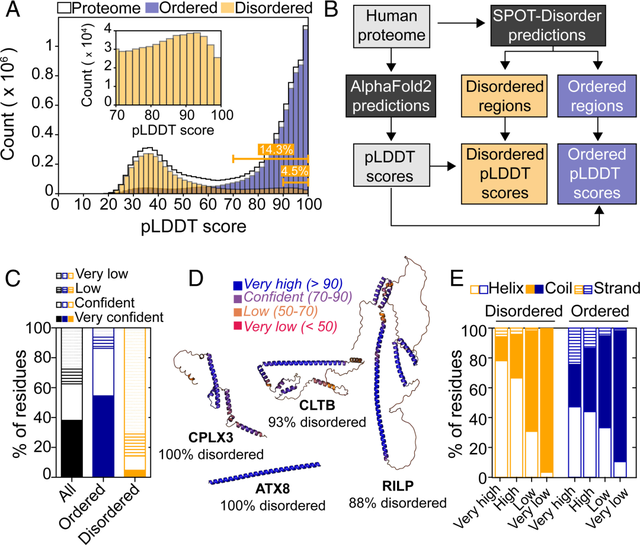
图:人类蛋白质组中预测的 IDR 在 AFDB 中具有可靠的结构。(来源:论文)
多伦多大学的研究团队指出,AlphaFold2可以预测数千个无序区域(IDR)的折叠情况,并根据预测局部差异距离测试(pLDDT)的分数来衡量结构预测的可信度。根据研究结果,预测得分在70≤x<90之间被视为高置信度,而≥90则被视为非常高置信度
研究人员发现,与具有低 pLDDT 分数的 IDR 相比,具有高 pLDDT 分数的 IDR 的氨基酸序列表现出更多的位置保守性。只有 4% 的具有高 pLDDT 分数的 IDR 序列在 PDB 中具有比对匹配,这表明结构模板并不是 AlphaFold2 自信地折叠这些 IDR 的原因。
对于在特定条件下折叠的 IDR 子集,例如在结合伴侣存在下或翻译后修饰(PTM)后,并且已通过 NMR 光谱进行了广泛表征,该团队发现这些 IDR 的 AlphaFold2 结构类似于折叠状态的构象。
此外,对于已知在特定条件下折叠的 1,400 多个 IDR,研究人员观察到 AlphaFold2 置信度分数能够预测条件折叠。这表明 AlphaFold2 可以系统地识别在结合或修饰时折叠的无序区域。
与具有低置信度分数的 IDR 相比,具有高置信度 AlphaFold2 分数的 IDR 富含疾病相关突变。研究人员利用 AlphaFold2 比较真核生物、细菌和古细菌中的条件折叠,发现原核生物显示条件折叠 IDR 的比例要高得多,这使该团队得出结论,绝大多数真核 IDR 无需采用结构即可发挥作用。研究人员建议,具有高 pLDDT 分数的 IDR 可能会在存在特定结合伴侣或遵循 PTM 的情况下折叠,他们将其称为条件折叠。
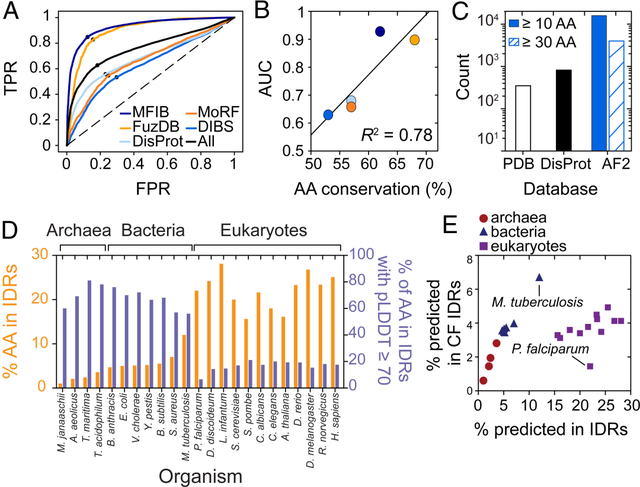
图:系统鉴定古细菌、细菌和真核生物中条件折叠的 IDR。(来源:论文)
讨论与结语
该团队的发现意义重大,因为 AlphaFold2 没有接受过预测 IDR 结构的训练,并且 IDR 也没有包含在其训练数据中。「这就像人工智能被训练来驾驶汽车,然后尝试看看它是否也可以驾驶公共汽车。」Moses 说,「它不能很好地驾驶公共汽车,但它可以识别出应该有人驾驶。」
这个团队也是第一个对人类和其他生物体中的所有蛋白质进行系统研究的团队。"所以,我们第一次相信我们知道这种情况发生的频率。"摩西说,"这很重要,因为生物学充满了例外。我们需要知道什么是常见的,什么是特殊的。"
AlphaFold2 这一强大且出人意料的应用的开发展示了利用人工智能解决蛋白质折叠问题的力量,并将提高研究人员对 IDR 及其在疾病中的作用的理解。
「在 AlphaFold2 预测具有某种结构的 IDR 中,我们已经证明突变比其他无结构 IDR 中的突变更有可能导致疾病。」Moses 说,「这是理解 IDR 突变如何导致疾病的重要进展,而人们通常对此还没有很好的了解。我们现在相信,许多突变正在以某种方式破坏结构。」
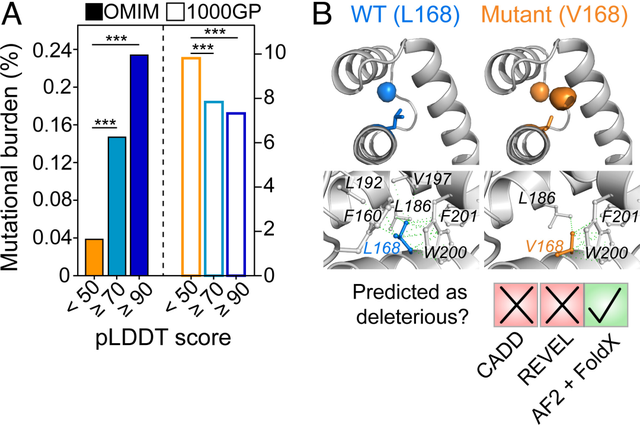
图:使用 AlphaFold2 了解条件折叠 IDR 中致病突变的基础。(来源:论文)
「更重要的是,由于 AlphaFold2 预测已经适用于所有蛋白质,现在我们第一次可以说出生命树中有多少 IDR 具有结构。我们的论文表明,细菌 IDR 比人类和动物 IDR 更有可能具有结构。据我们所知,这是第一次注意到这一点,它可能会解决有关大多数 IDR 是否有结构的持续争论。」
论文链接:https://www.pnas.org/doi/10.1073/pnas.2304302120
相关报道:https://phys.org/news/2023-11-powerful-ai-tool-gain-insights.html
产品推荐
-

售后无忧
立即购买>- DAEMON Tools Lite 10【序列号终身授权 + 中文版 + Win】
-
¥150.00
office旗舰店
-

售后无忧
立即购买>- DAEMON Tools Ultra 5【序列号终身授权 + 中文版 + Win】
-
¥198.00
office旗舰店
-

售后无忧
立即购买>- DAEMON Tools Pro 8【序列号终身授权 + 中文版 + Win】
-
¥189.00
office旗舰店
-

售后无忧
立即购买>- CorelDRAW X8 简体中文【标准版 + Win】
-
¥1788.00
office旗舰店
-
 正版软件
正版软件
- 智能家居的私人生活彻底改变:人工智能的影响
- 自动化、控制和易用性是智能家居众所周知的功能,但是各位有没有想过这些技术能走多远?智能家居的功能是否存在任何限制?如果存在,那么限制在哪里?人工智能的表面几乎没有被触及,人工智能是最新的事物,正在彻底改变日常生活。通过将人工智能融入智能家居技术,我们可以实现很多目标。一旦学会利用现代科技带来的所有好处,将改善日常生活并享受居住的便利和舒适。人工智能驱动的家庭自动化随着时间的推移,虚拟助手经过训练,可以识别声音并听取命令,从而执行任务,也可以轻松简化日常任务。一旦将人工智能助理与家庭设备集成,可以在座位上完
- 48分钟前 人工智能 AI 智能家居 0
-
 正版软件
正版软件
- 首款AI超轻薄本图赏:1.19kg、酷睿Ultra 7,灵耀14 2024已开售
- 2024年轻薄笔记本行业的发展趋势是轻量化和AI智能。随着今年AIGC的热潮,AIGC创作开始流行,所以AI智能也将成为一大发展趋势。在12月15日,华硕发布了灵耀142024新品,这是首款酷睿Ultra新品AIPC轻薄本。让我们结合开箱体验来聊一聊它的亮点首先是外观设计方面,华硕灵耀142024延续了灵耀系列一贯的设计语言,A面通过采用几何线条勾勒出了品牌LOGO,简洁、辨识度兼具。而且实际上手后能发现,质感还是相当在线的,毕竟是全金属机身,而且机身比较轻薄,要比当前主流的轻薄本更轻、更薄,实测后发现,
- 13小时前 04:05 0
-
 正版软件
正版软件
- DeepMind论文登上Nature:困扰数学家几十年的难题,大模型发现全新解
- 作为今年人工智能领域的顶尖技术,大型语言模型(LLM)擅长于将概念进行组合,并通过阅读、理解、写作和编码来帮助人们解决问题。但是,它们是否能够发现全新的知识呢?鉴于LLM已被证明存在"幻觉"问题,即生成与事实不符的信息,因此利用LLM进行可验证的正确发现是一项具有挑战性的任务现在,来自GoogleDeepMind的研究团队提出了一种为数学和计算机科学问题搜索解决方案的新方法——FunSearch。FunSearch的工作原理是将预训练的LLM(以计算机代码的形式提供创造性解决方案)与自动「评估器」配对,以
- 昨天 05-17 04:00 模型 数据 0
-
 正版软件
正版软件
- 联想王传东:AI PC将成为个人信息的安全保险箱
- 12月15日消息,联想集团副总裁、中国区首席市场官王传东近日在公开活动中分享了他对于AI的洞察。王传东表示,AI时代,数据是最宝贵的资源,AIPC以其设备级个人数据和隐私安全保护的核心特征,成为AI时代个人的“数字保险箱”。王传东在分享中表示,2024年将会是人工智能个人电脑的元年,它将对每个人的工作、学习和生活产生深远的影响。人工智能个人电脑不仅仅是一个生产力工具,它还将成为每个人的个人AI助手,为用户提供四大价值,包括:在通用场景下提供个性化服务、即时可靠的智能服务、更低的大型模型使用成本、以及可信安
- 前天 05-16 03:55 0
-
 正版软件
正版软件
- 真实、可控、可拓展,自动驾驶光照仿真平台LightSim上新了
- 最近,WaabiAI、多伦多大学、滑铁卢大学和麻省理工的研究者们在NeurIPS2023上提出了一个全新的自动驾驶光照仿真平台LightSim。研究者们提出了一种从真实数据中生成配对光照训练数据的方法,解决了数据缺失和模型迁移损失的问题。LightSim利用神经辐射场(NeRF)和基于物理的深度网络渲染车辆驾驶视频,首次在大规模真实数据上实现了动态场景的光照仿真项目网站:https://waabi.ai/lightsim论文链接:https://openreview.net/pdf?id=mcx8IGne
- 4天前 模型 训练 0
最新发布
-
 1
1
- 阿里追捧的中台,“热度”退了?
- 1620天前
-
 2
2
- Overture设置踏板标记的方法
- 1457天前
-
 3
3
- 思杰马克丁取得CleanMyMac中国区独家发行授权
- 1447天前
-
 4
4
- IBM:20万台Mac让公司职工在工作中更快乐 更多产
- 1645天前
-
 5
5
- 报道称微软一直在悄然游说反对“维修权”立法!
- 1611天前
-
 6
6
- 美国怀疑华为窃取商业机密 华为:身正不怕影子斜
- 1607天前
-
 7
7
- 三星被曝正与联发科接洽 A系列手机有望搭载其5G芯片
- 1622天前
-
 8
8
- 环球墨非完成千万级融资 联合企业集团投资
- 1643天前
-
 9
9
相关推荐
- 首款AI超轻薄本图赏:1.19kg、酷睿Ultra 7,灵耀14 2024已开售
- DeepMind论文登上Nature:困扰数学家几十年的难题,大模型发现全新解
- 联想王传东:AI PC将成为个人信息的安全保险箱
- 真实、可控、可拓展,自动驾驶光照仿真平台LightSim上新了
- 新的标题为:荣耀 90 GT 发布会日期确认:性能强悍的霸主即将亮相
- 荣耀90 GT规格首曝:搭载第二代骁龙8芯片 100W快充来势汹汹
- 联想小新Pro 14/16 2024系列的独特之处:IdeaPad Pro 5i
- 领克汽车全新09 EM-P车型即将预售,定位“超电SUV旗舰”
- 韩国:计划2030年向机器人产业投资3万亿韩元,机器人产业规模将超20万亿韩元【附机器人行业发展现状分析】
热门关注
-

- Xshell 6 简体中文
- ¥899.00-¥1149.00
-

- DaVinci Resolve Studio 16 简体中文
- ¥2550.00-¥2550.00
-

- Camtasia 2019 简体中文
- ¥689.00-¥689.00
-

- Luminar 3 简体中文
- ¥288.00-¥288.00
-

- Apowersoft 录屏王 简体中文
- ¥129.00-¥339.00