化学氢氧燃料电池
 发布于2025-02-01 阅读(0)
发布于2025-02-01 阅读(0)
扫一扫,手机访问

化学氢氧燃料电池
在酸溶液中负极反应式为:2H2-4e-==4H+ 正极反应式为:O2 + 4H+ +4eˉ== 2H2O
电解质溶液是碱或中性溶液则负极反应式为:2H2 + 4OHˉ-4eˉ== 4H20 正极为:O2 + 2H2O + 4eˉ== 4OHˉ
工作时,燃料电池将氢供给负极,氧化剂供给正极。氢在负极分解成H+离子和电子e-,H+离子进入电解液,电子通过外部电路流向正极,负载连接在外部电路上。正极上的氧与电解液中的H+离子结合,吸收电子形成水,这是水的电解反应的逆过程。
氢氧燃料电池的工作过程是这样的:在氢电极供应氢气的同时,向氧电极供应氧气。在电解质的催化剂作用下,氢和氧气发生反应,生成水。在这个过程中,氢电极上会有多余的电子,带负电荷,而氧电极上缺少电子,带正电荷。当电路连通时,这个类似于燃烧的反应过程就能持续进行下去。
氢氧燃料电池
石墨是一种多孔结构材料,具有巨大的表面积比。在潮湿条件下,由于氢气和氧气的电负性差异,会形成一个回路放电(当负载被断开时,会表现为两极间的电压)。这个过程中,氢气和氧气会重新形成离子态并进入溶液中,而离子在溶液中中和后会再次转化为水。这就是氢氧燃料电池的原理。要理解这个原理,可以参考浓差电池的工作原理,该原理在大学的相关学科中有所涉及。
浓差电池是一种结构简单的电池,它由两块极板和一层溶液构成。极板之间的溶液中含有某种气体,其浓度在两端不同。根据浓度差异,气体会从高浓度一侧向低浓度一侧扩散。在这个过程中,气体首先通过多孔的极板材料(如多孔铂)吸收电子,以离子形式进入溶液中。然后,在另一个极板上,气体会释放出电子,重新转化为气体并释放到外界。通过这种扩散过程,浓差电池完成了能量转化的过程。
电负性是元素吸收电子的能力。举例来说,氧的电负性较高,易于吸附电子,而氢的电负性较低,易于失去电子。电负性差异越大,形成的原电池电压就越高。
如果还不明白可以给我发站内消息。
氢氧燃料电池反应原理的化学式是什么意思
燃料电池(Fuel Cell, FC)根据电解质的不同可以分为碱性燃料电池(AFC)、磷酸型燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)以及质子交换膜燃料电池(PEMFC)等几种类型。碱性燃料电池仅指AFC,其余都属于酸性燃料电池,并不存在所谓的中性燃料电池。不过,有些燃料电池使用的电解质是弱酸或弱碱,接近于中性。
燃料电池的电极反应式与其电解质的酸碱性紧密联系。
当电解质溶液接近中性时:
负极:2H2-4e=4H+ 正极:O2+4e+2H2O=4OH-
当电解质溶液呈酸性时:
负极:2H2-4e=4H+ 正极:O2+4e+4H+=2H2O
当电解质溶液呈碱性时:
负极:2H2-4e+4OH-=4H2O 正极:O2+4e+2H2O=4OH-
注意所有的电子e都省略了负号上标,书写时应当加上。
氢燃料电池相关内容
氢燃料电池技术原理是将化学能转变为电能,不会排放一氧化氮(Nitric oxide)、煤烟或硫氧化物等大量废气,所生成的副产物仅限于热、水及少量的二氧化碳,且热能远低于一般燃烧石油所产生的热值,故有「冷燃烧」之说法。因此,它是一个非常干净的能源发展技术。
但由于氢气难以运输,氢燃料基础设施目前仍为该技术发展挑战之一。而且氢气属于一种具有爆炸危险性的物质,必须要具备安全且适当的操作程序输送。但现时的工业环境已有成熟且完善的技术管线输送氢气。
氢氧燃料电池即为水之电解的逆反应,透过氧化还原反应将燃料中的化学能转换为电能,透过燃料也就是氢气,于发电过程中利用不断供应的氧气与燃料稳定发电。
氢氧燃料电池的原理如下:
氧气在阴极与水结合形成氢氧根离子,氢氧根离子(Hydroxide)游离到阳极与氢离子结合,形成水,所释放出来的电子形成电流。氢氧燃料电池的全反应式如下:
全反应:H2+ ½O2 →H2O
产品推荐
-

售后无忧
立即购买>- DAEMON Tools Lite 10【序列号终身授权 + 中文版 + Win】
-
¥150.00
office旗舰店
-

售后无忧
立即购买>- DAEMON Tools Ultra 5【序列号终身授权 + 中文版 + Win】
-
¥198.00
office旗舰店
-

售后无忧
立即购买>- DAEMON Tools Pro 8【序列号终身授权 + 中文版 + Win】
-
¥189.00
office旗舰店
-

售后无忧
立即购买>- CorelDRAW X8 简体中文【标准版 + Win】
-
¥1788.00
office旗舰店
-
 正版软件
正版软件
- Win10设置有线网卡自动获取IP地址的方法
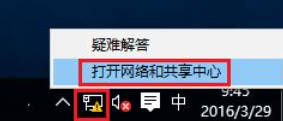
- win10系统的电脑想要自动获取ip地址该怎么设置,为了方便网络管理和减少配置复杂度,我们需要设置设备自动获取IP地址,我们通过整理相关技巧,将带大家一起看下怎么去进行操作。1、电脑与前端网络接口连接后,在电脑右下角找到网络图标,右键点击并选择打开网络和共享中心。2、在弹出的网络和共享中心页面,点击更改适配器设置。3、找到以太网,右键点击属性。4、找到并点击Internet协议版本4(TCP/IPv4),点击属性。5、选择自动获取IP地址(O),自动获得DNS服务器地址(B),点击确定。
- 刚刚 电脑 ip地址 0
-
 正版软件
正版软件
- Win11家庭版升级为专业版操作指南
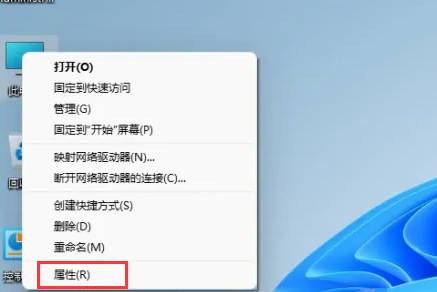
- Win11家庭版怎么转换成Win11专业版?在Win11系统中,分为了家庭版、专业版、企业版等,而大部分Win11笔记本都是预装Win11家庭版系统。而今天小编就给大家带来win11家庭版切换专业版操作步骤!1、首先在win11桌面此电脑上右键属性。2、点击更改产品密钥或升级windows。3、然后进入后点击更改产品密钥。4、再输入激活密钥:8G7XN-V7YWC-W8RPC-V73KB-YWRDB,选择下一步。5、接着就会提示成功,这样就可以将win11家庭版升级win11专业版了。
- 6分钟前 切换 win11 0
-
 正版软件
正版软件
- 如何停止Win11更新
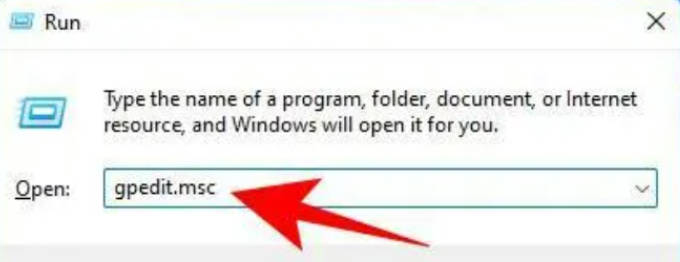
- Win11系统和之前的所有系统一样,也是有内置自动更新的功能的,不过不是所有人都喜欢自动更新的,那么要怎么关闭Win11的自动更新功能呢?下面小编给大家介绍win11关闭更新教程。1、按Win+R打开RUN框,输入gpedit.msc,然后按Enter。2、然后导航到左侧面板中的以下路径:ComputerConfiguration》AdministrativeTemplates》WindowsComponents》WindowsUpdate》Manageenduserexperience。3、现在,在右侧
- 20分钟前 win11 关闭更新 0
-
 正版软件
正版软件
- 如何在Win10设置锁屏密码?
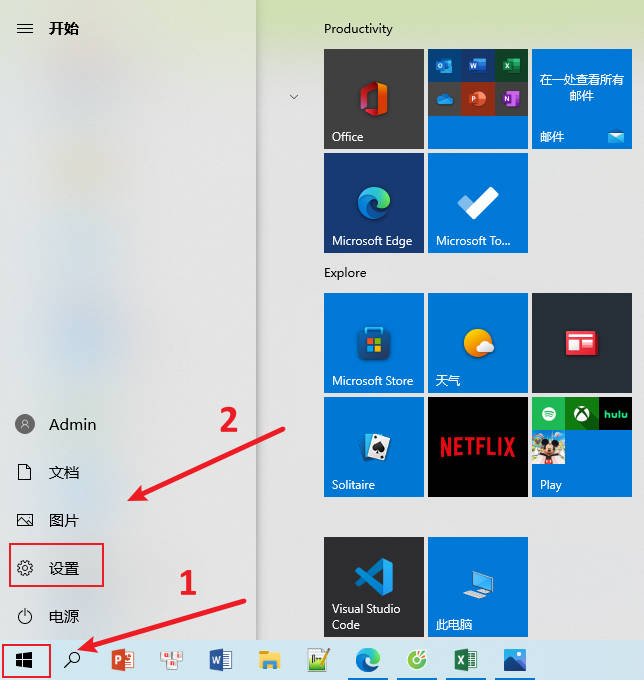
- 在我们日常生活中,最常见的就是开机密码了,而电脑作为我们使用频率最高也是最复杂的设备,其安全性也是非常重要的,那么电脑win10怎么设置锁屏密码?那么今天我们就来说一说win10怎么设置锁屏密码,希望可以帮到各位哦。1.打开电脑,在电脑桌面左下角点击【开始菜单】,在弹出的窗口,点击【设置】选项,即齿轮样式的图标。2.在Windows的设置页面,找到并点击【账户】。3.打开【账户】后,在弹出的窗口左侧找到【登录选项】并单击【密码】设置。
- 30分钟前 设置 win10 锁屏密码 0
-
 正版软件
正版软件
- 解决Win10中音频服务无法响应的方法
- Win10中出现音频服务未响应该怎么办呢?方法并不难,下面小编来告诉大家该怎么办,具体步骤如下:1、首先,我们点击我们电脑左下角的微软按钮,点击设置。弹出的界面,我们选择轻松使用。2、然后我们找到音频,之后我们点击它。然后我们将音频的滑动按钮朝着右边滑动。3、我们可以发现我们在音频中的滑动按钮是可以滑动的,滑动到一定阶段我们就可以停止了,这样音频未响应的问题也就解决了,一般是我们的电脑开机时间太久导致音频未响应的,其次我们还可以选择重启解决这个问题。
- 50分钟前 win10 音频服务 0
最新发布
-
 1
1
- KeyShot支持的文件格式一览
- 1803天前
-
 2
2
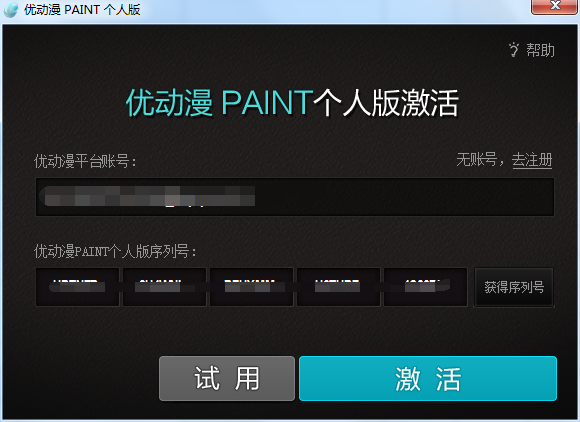
- 优动漫PAINT试用版和完整版区别介绍
- 1843天前
-
 3
3
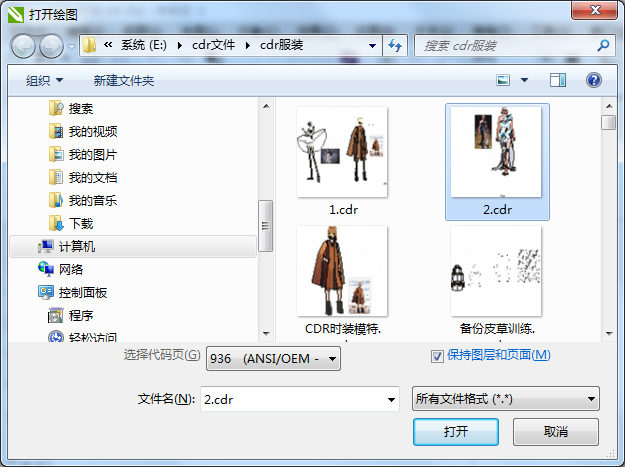
- CDR高版本转换为低版本
- 1988天前
-
 4
4
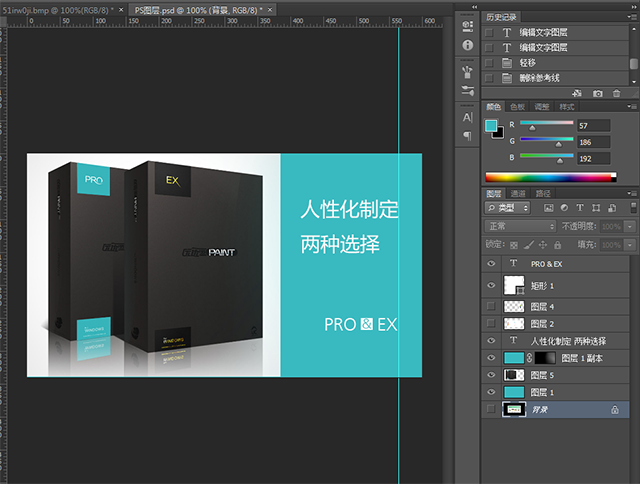
- 优动漫导入ps图层的方法教程
- 1842天前
-
 5
5
- ZBrush雕刻衣服以及调整方法教程
- 1838天前
-
 6
6
- 修改Xshell默认存储路径的方法教程
- 1854天前
-
 7
7
- Overture设置一个音轨两个声部的操作教程
- 1832天前
-
 8
8
- CorelDRAW添加移动和关闭调色板操作方法
- 1881天前
-
 9
9
- PhotoZoom Pro功能和系统要求简介
- 2008天前
相关推荐
热门关注
-

- Xshell 6 简体中文
- ¥899.00-¥1149.00
-

- DaVinci Resolve Studio 16 简体中文
- ¥2550.00-¥2550.00
-

- Camtasia 2019 简体中文
- ¥689.00-¥689.00
-

- Luminar 3 简体中文
- ¥288.00-¥288.00
-

- Apowersoft 录屏王 简体中文
- ¥129.00-¥339.00